赵扬团队报道在体重编程诱导心肌细胞再生的微环境调控机制
2024年3月26日,我室赵扬研究团队在Protein&Cell期刊上发表了题为Macrophages suppress cardiac reprogramming of fibroblasts in vivo via IFN-mediated intercellular self-stimulating circuit的研究论文【1】。该研究通过比较心脏成纤维细胞体内、外诱导重编程为心肌细胞过程中的分子路径差异,揭示了心脏损伤后心梗区域富集的巨噬细胞通过干扰素信号通路IFN-β/IFNAR/p-STAT1抑制心脏成纤维细胞的在体原位重编程。此外,巨噬细胞介导的心脏成纤维细胞的IFN信号通路被激活后,会激活表达CCL2/7/12等一系列趋化因子,从而进一步招募巨噬细胞,形成细胞间IFN信号强化激活的正反馈环路。如果在心脏成纤维细胞中抑制IFN-β/IFNAR/p-STAT1信号通路或直接清除巨噬细胞能够有效促进重编程因子诱导的心脏成纤维细胞向心肌样细胞的谱系重编程(转分化),并显著缓解小鼠心肌梗死症状,改善心脏功能。
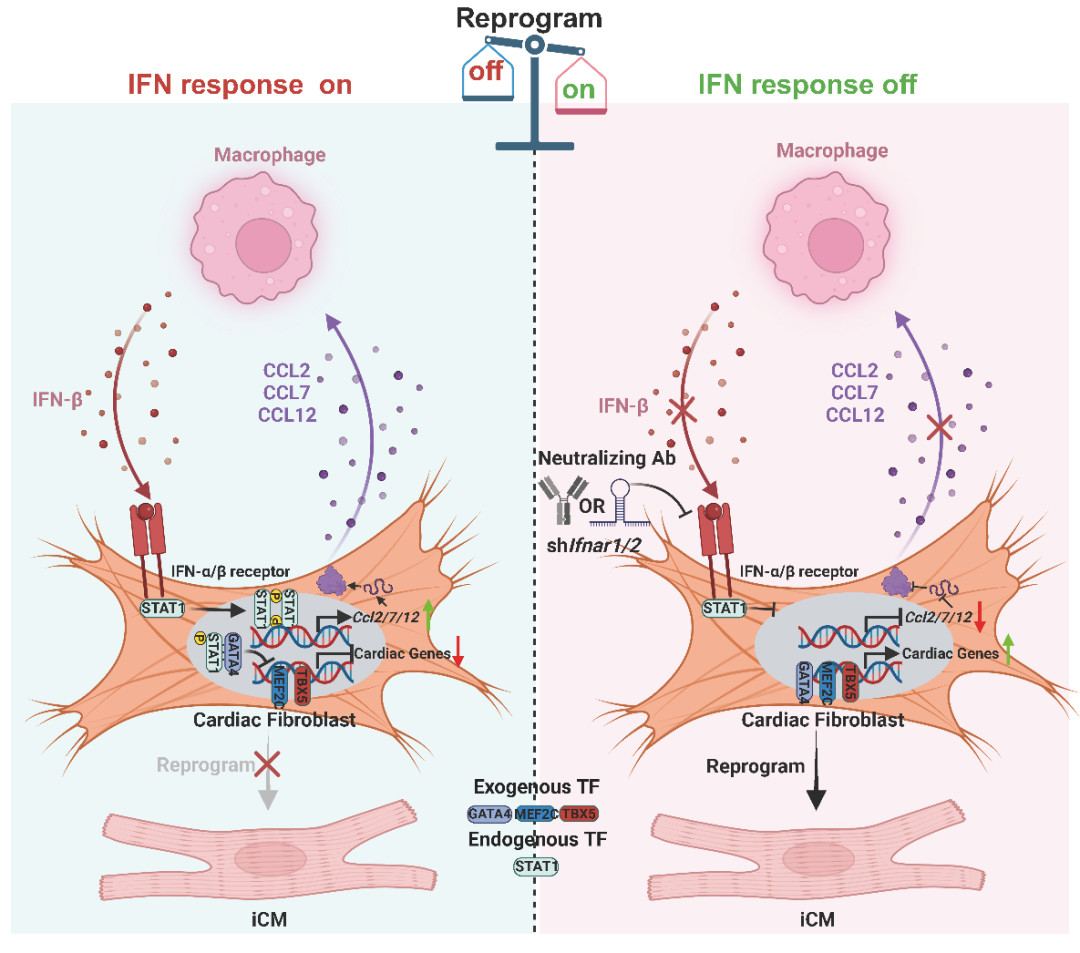
心脏成纤维细胞与巨噬细胞通过IFN-IFNAR-p-STAT1信号轴形成的细胞间正反馈回路模式图
冠状动脉粥样硬化、心肌梗死等心血管疾病是当今世界危害人类健康的主要原因之一。该类疾病会导致心肌细胞大量死亡,难以再生,并且心脏成纤维细胞会被代偿性激活、增殖、分泌胶原,导致心脏纤维化。在心脏成纤维细胞中过表达转录因子组合MGT(Mef2c, Gata4, Tbx5)可将其重编程成为心肌细胞,是减轻心脏纤维化、并同时实现心脏再生的新策略【2】。尽管MGT可以在体外有效诱导乳鼠/成年健康小鼠心脏成纤维细胞重编程为心肌细胞,但是这组重编程因子针对心梗后成年小鼠心脏成纤维细胞的诱导效率极低,在体诱导重编程的效率也有较大提升空间。针对这一问题,赵扬团队开展了心梗微环境如何调控在体细胞重编程的探索。
为了避免体内、外重编程基因递送差异带来的影响,赵扬团队设计了一种可诱导重编程的细胞移植体系来开展在体重编程研究。他们首先分离了成年心梗小鼠的心脏成纤维细胞(MICFs),在体外转染了该团队曾经报道的一个高效重编程因子组合【3】,并采用Tet-on可诱导表达系统控制这些基因的表达。转入重编程基因MICFs中的一部分被收集用于移植到小鼠心脏梗死区域、诱导在体重编程;而剩下的则用于体外贴壁培养、诱导体外重编程。通过两者的转录组对比分析发现,心肌相关基因在在体细胞重编程样本中的表达量非常有限,但显著上调了干扰素(Interferon, IFN)信号通路相关基因。进一步实验表明,通过shRNA敲低Ⅰ型干扰素受体(Interferon-α/β receptor, IFNAR)能显著提高损伤后心脏成纤维细胞体内、外重编程的效率。更重要的是,在体内原位心脏成纤维细胞中递送shIfnar2,不仅可提高重编程因子组合MGT介导的在体重编程效率,而且显著提升了心梗后小鼠心脏的收缩功能,降低了纤维化程度。
据报道,心梗之后,骨髓来源的单核细胞会浸润到心梗区域分化为巨噬细胞,并进一步建立起免疫激活的微环境,使心脏进入炎性阶段【4】;而单细胞RNA测序数据表明,IFN-β是心梗后IFN信号通路配体的主要来源,并且主要由巨噬细胞分泌。因此,研究团队又把研究目标进一步锁定在巨噬细胞上。经过验证,研究者发现,巨噬细胞的条件性培养液以及其中的IFN-β成分确实可以显著降低体外的重编程效率。心梗区域分离的成纤维细胞经过纯化去除巨噬细胞后也可以显著提高体外重编程效率。此外,利用巨噬细胞清除剂在体清除心梗后的巨噬细胞,或注射IFNAR中和抗体均可以显著提高重编程因子介导的心肌样细胞诱导效率。
分子机制的研究表明,IFN-β刺激MICFs中STAT1的磷酸化以抑制心脏重编程过程。BiFC、Co-IP和CUT&Tag等分析进一步揭示了磷酸化的STAT1可以与重编程因子GATA4相互作用,干扰GATA4在心肌相关基因座上的占位,从而降低心肌细胞的诱导效率。此外,细胞迁移等实验结果表明,IFN-IFNAR-p-STAT1信号通路的激活会刺激成纤维细胞中C-C基序趋化因子2/7/12(C-C Motif Chemokine Ligand 2/7/12, CCL2/7/12)的分泌,从而招募分泌IFN-β的巨噬细胞。而招募的巨噬细胞会进一步分泌IFN-β刺激MICFs中STAT1的磷酸化,进而在成纤维细胞和巨噬细胞之间形成强化激活的正反馈回路,从而严重阻碍心脏重编程发生。靶向IFN或巨噬细胞均能够阻断这条正反馈回路,显著提高在体原位的重编程效率,结合重编程因子明显改善心梗损伤后的心脏功能。
综上所述,赵扬团队的这项研究结果揭示了巨噬细胞、IFN/IFNAR/p-STAT1信号通路以及巨噬细胞和成纤维细胞之间互作的调控回路是心脏在体原位重编程的主要微环境障碍,抑制这一障碍机制有助于真正解锁重编程诱导心肌细胞原位再生的潜能,为进一步实现心脏疾病的“重编程治疗”提供了理论基础。
北京大学前沿交叉学科研究院2019级博士生王浩和未来技术学院2019级博士生杨峻博是该研究的第一作者。北京大学未来技术学院2021级博士生蔡依弘对该研究做出了重大贡献。赵扬研究员是该研究的通讯作者。
论文链接:https://academic.oup.com/proteincell/advance-article/doi/10.1093/procel/pwae013/7635154
参考文献:
1. Wang, H., Yang, J., Cai, Y., and Zhao, Y. (2024). Macrophages suppress cardiac reprogramming of fibroblasts in vivo via IFN-mediated intercellular self-stimulating circuit. Protein & Cell.
2. Ieda, M. et al. (2010). Direct reprogramming of fibroblasts into functional cardiomyocytes by defined factors. Cell.
3. Zhao, H. et al. (2019) Sall4 and Myocd Empower Direct Cardiac Reprogramming From Adult Cardiac Fibroblasts After Injury. Front Cell Dev Biol.
4. O'Rourke, Sinead A et al. (2019) The Role of Macrophages in the Infarcted Myocardium: Orchestrators of ECM Remodeling. Frontiers in cardiovascular medicine.

