熊敬维团队发现斑马鱼心脏再生表观因子Brg1调节Notch信号的新机制
心血管疾病, 尤其是心肌梗死, 是造成人类死亡的重大疾病。由于缺乏血液供应,大量心肌细胞在心肌梗死后几个小时内会发生凋亡和坏死, 且成年哺乳动物心肌细胞再生能力差, 心梗最终会造成心脏纤维化、心脏收缩功能丧失和心力衰竭。不同于成年哺乳动物,成年斑马鱼心脏可以再生,但是成体心脏再生非常复杂,多种心脏细胞参与其中。其中内皮细胞对于心脏再生过程中血管新生是必要的,研究发现内皮细胞中FGF, RA, Notch等信号通路参与调控心脏再生。
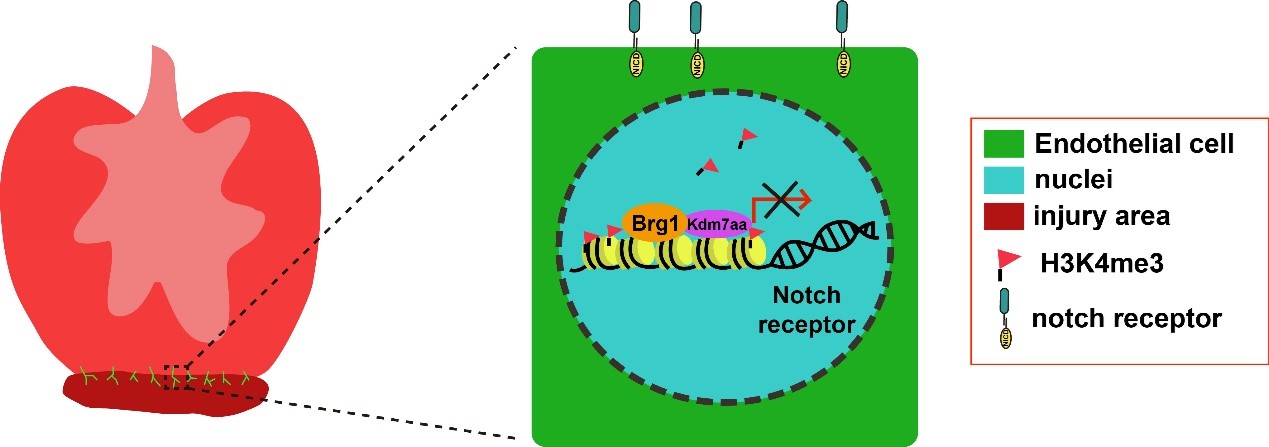
我室熊敬维团队2023年4月7日在npj Regenerative Medicine杂志在线发表了题为“Endothelial Brg1 fine-tunes Notch signaling during zebrafish heart regeneration”的研究论文,该工作发现了内皮细胞中Brg1可以通过与Kdm7aa相互作用,降低Notch受体基因启动子区域的H3K4me3水平,从而调节Notch信号和斑马鱼心脏再生,揭示了斑马鱼心脏再生中Brg1调控Notch信号的新机制。
熊敬维团队前期研究发现,染色质重构复合物核心催化亚基Brg1(brahma-related gene 1, brg1 或 smarca4 )对于斑马鱼心脏再生是必要的,且心肌细胞中的Brg1通过与DNA甲基转移酶DNMT3ab((cytosine-5)-methyltransferase 3 alpha b)相互作用调控细胞周期蛋白依赖性激酶抑制剂 cdkn1c (cyclin-dependent kinase inhibitor 1c)启动子区域的DNA甲基化水平,进而调控斑马鱼心肌细胞增殖和再生(Xiao and Gao et al., 2016 Nature Communications)。其中,相比于心肌特异性抑制Brg1功能,全身性抑制Brg1功能会导致斑马鱼心脏再生过程中更严重的纤维化,该结果提示除心肌细胞以外,其他细胞类型中的Brg1可能在斑马鱼心脏再生中有重要功能。
在该项研究中,研究人员构建了内皮细胞中特异性过表达显性负抑制Brg1基因的转基因斑马鱼品系,对其进行心尖切除手术后,发现抑制内皮细胞Brg1功能导致心脏不能再生,伤口处疤痕残留,并且心肌细胞增殖受到抑制。结合H3K4me3 ChIP-seq和内皮细胞转录组数据分析,发现Brg1通过直接调控Notch受体基因启动子区域的H3K4me3水平,从而负调控Notch信号的激活。进一步发现内皮细胞中过表达 Notch 信号明显降低心肌细胞增殖参数;而Notch siRNA 或者小分子抑制剂可以部分拯救Brg1突变体心脏中心肌细胞增殖参数。分子机制研究发现斑马鱼心脏损伤后 kdm7aa 的表达上调,Brg1可与Kdm7aa相互作用调节Notch受体基因启动子区域的H3K4me3水平,从而抑制Notch信号的过度激活以保证斑马鱼心脏的正常再生。
北京大学未来技术学院分子医学研究所博士后肖成路(已出站,现工作单位为中国农业大学动物医学院)和2017级博士生侯俊杰为文章共同第一作者,北京大学研究生郑纪元(已毕业)和清华大学博士研究生宋亚冰参与部分研究工作。 北京大学未来技术学院熊敬维教授,朱小君研究员和丁晚秋博士为共同通讯作者。该工作得到浙江工业大学王芳副研究员,西南大学罗凌飞教授和清华大学王建斌教授等的指导和合作。该研究工作得到国家自然科学基金委项目和科技部发育编程及代谢调节专项的大力支持,肖成路得到博雅博士后项目以及生命科学联合中心博士后基金的支持。
论文链接:https://www.nature.com/articles/s41536-023-00293-4

