马明团队解析复杂二萜cattleyene生物合成机制并通过酶工程改造获得新骨架产物
2022年7月12日,我室马明研究团队在国际著名期刊Angew. Chem. Int. Ed.上发表了题为“Crystal structure based mutagenesis of cattleyene synthase leads to the generation of rearranged polycyclic diterpenes”的研究论文。该研究通过解析二萜环化酶晶体结构揭示复杂四环二萜cattleyene生物合成机制,并基于晶体结构开展定点突变改变酶的产物结构,获得新骨架二萜化合物。

二萜类天然产物是萜类家族中结构多样性最强的一类化合物(已发现大约18000个),且具有多种生物活性。这类化合物的化学骨架多样性主要归功于二萜环化酶的催化,该类酶可以将20个碳原子的通用线装底物GGPP转化成各种富含手性中心和环系结构的二萜产物。然而,相对于二萜类化合物的大量发现,二萜环化酶的结构和催化机制研究大为滞后,尤其是对它们如何催化产生多环二萜的理解比较欠缺。
Cattleyene(1)是一个新骨架的四环二萜,具有不同于其它二萜化合物的5/5/6/5环系结构。马明团队针对cattleyene的二萜环化酶CyS开展了研究,解析了CyS的母体晶体结构(2.00 Å)、CyS与原始底物GGPP的复合物晶体结构(1.87 Å)。该复合物晶体结构首次揭示了原始底物GGPP在二萜环化酶活性口袋中的结合信息,而不是文献报道中的GGPP类似物的结合信息。进一步深入分析发现CyS活性口袋中的多个芳香性氨基酸可以通过cation-π相互作用稳定碳正离子中间体,分子对接实验揭示了CyS从结合GGPP到生成cattleyene的完整环化过程。
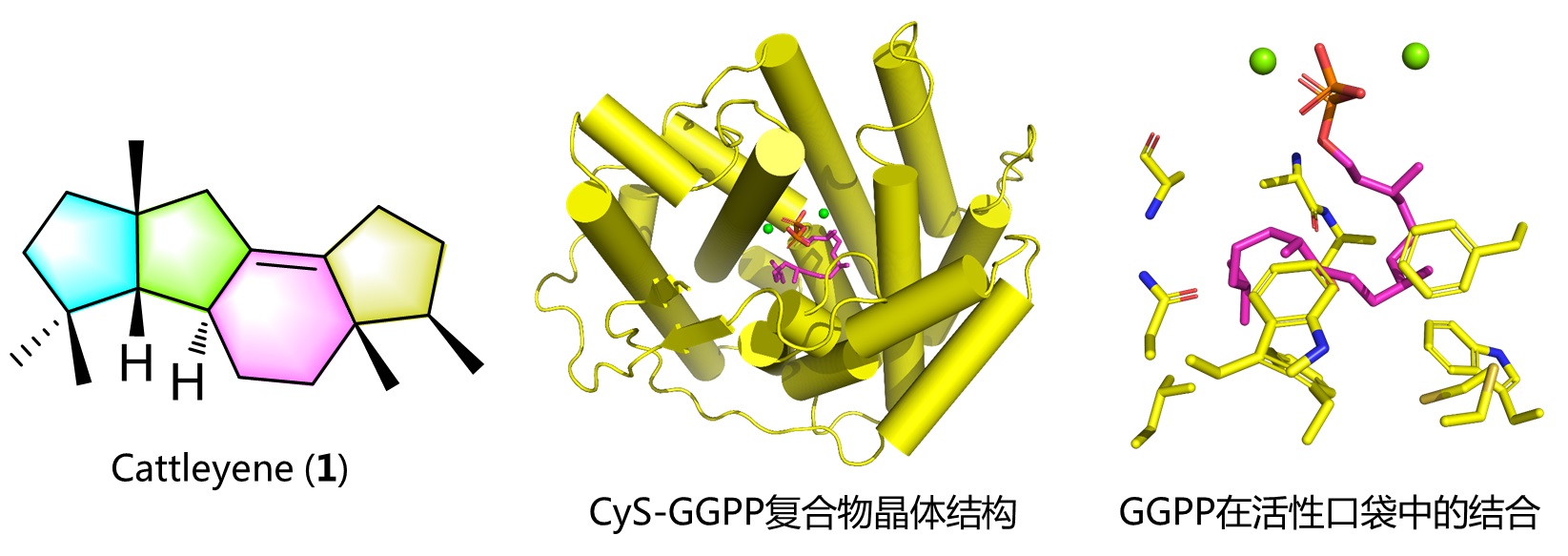
图1 四环二萜cattleyene的结构、二萜环化酶CyS晶体结构,以及GGPP在CyS中的结合
研究团队开展了定点突变研究,验证了CyS活性口袋中的关键氨基酸残基的功能。关键残基的突变导致无法稳定碳正离子中间体,使得生物合成流向上游旁路路径,产生不同骨架的二萜产物。出乎意料的是,一个远离GGPP结合口袋的突变C59A除了产生cattleyene外,还产生了5个不同环系新产物(化合物2-5)。研究团队进而解析了CySC59A突变体的晶体结构(2.30 Å),揭示了半胱氨酸C59虽然不与底物GGPP直接相互作用,但是其突变为丙氨酸后空间位阻减小,松弛了活性口袋,使得突变后的酶能够更快地结合底物并催化反应,但同时失去了只产生cattleyene一个产物的专一性。
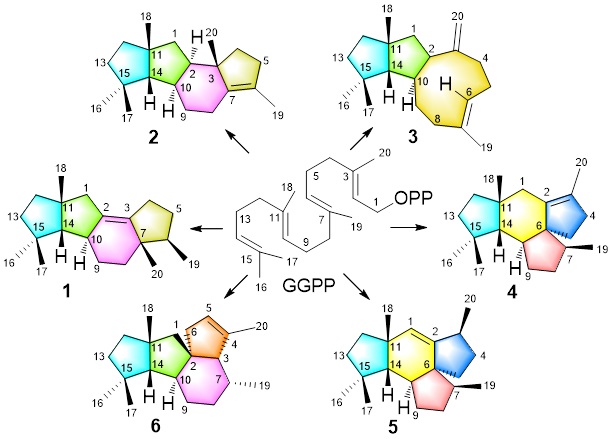
图2 CyS定点突变产生不同骨架的二萜产物
鉴于突变体产物化合物6是一个新骨架四环二萜,它的环化机制无法通过经验进行简单的推测,因此研究团队通过一系列13C 和2H的同位素标记实验,揭示了化合物6形成中所经历的多种骨架重排和氢负离子迁移的过程。
北京大学药学院博士生邢佰颖、德国波恩大学Houchao Xu为本论文共同第一作者,北京大学药学院马明研究员、杨东辉副教授,波恩大学Jeroen S. Dickschat教授为共同通讯作者。

邢佰颖 博士生
论文链接:https://doi.org/10.1002/anie.202209785
【通讯作者简介】

马明,北京大学药学院、天然药物及仿生药物国家重点实验室研究员,博士生导师,长聘副教授。研究领域为天然药用功能分子的生物合成,酶的三维结构及其催化机制,以及天然产物合成生物学。近5年以通讯作者在Angew. Chem. Int. Ed.、JACS、ACS Catal.、Chem. Sci.、Commun. Chem.、Org. Lett.、J. Biol. Chem.、J. Org. Chem.、J. Nat. Prod.等国际学术期刊发表论文15篇。任中国药学会海洋药物专业委员会委员、中华中医药学会青年委员会委员、北京药学会天然药物专业委员会委员。

杨东辉,北京大学药学院副教授,研究方向为天然药源分子的发现与生物合成。以通讯作者在Commun. Chem.、Org. Lett.、J. Org. Chem.、J. Nat. Prod.、Appl. Microbiol. Biotechnol.、Mar. Drugs等本领域权威期刊发表学术论文28篇。担任世中联中药化学专业委员会常务理事、中西医结合学会分子生药学专业委员会委员、中国民族医药学会药用资源委员会理事。

