刘国全团队揭示光动力疗法在肿瘤细胞中诱发了一种新的细胞死亡通路

近日,我室刘国全团队在国际“氧化还原生物学与医学协会(SfRBM)”的官方期刊《Redox Biology》在线发表了题为“Non-enzymatic lipid peroxidation initiated by photodynamic therapy drives a distinct ferroptosis-like cell death pathway”的研究工作。
铁死亡是近年来新发现的一种细胞死亡通路,在肿瘤治疗领域受到了广泛的关注。多种耐药或处于治疗抵抗状态的肿瘤细胞都显示了对铁死亡通路额外的敏感性,而T细胞也可能利用了铁死亡通路来促进其细胞毒效应。铁死亡的主要特征是细胞中发生了依赖于铁的细胞膜脂质过氧化。然而,细胞内发生脂质过氧化的机制目前不明确,该过程是酶促还非酶促主导的仍存在争议。
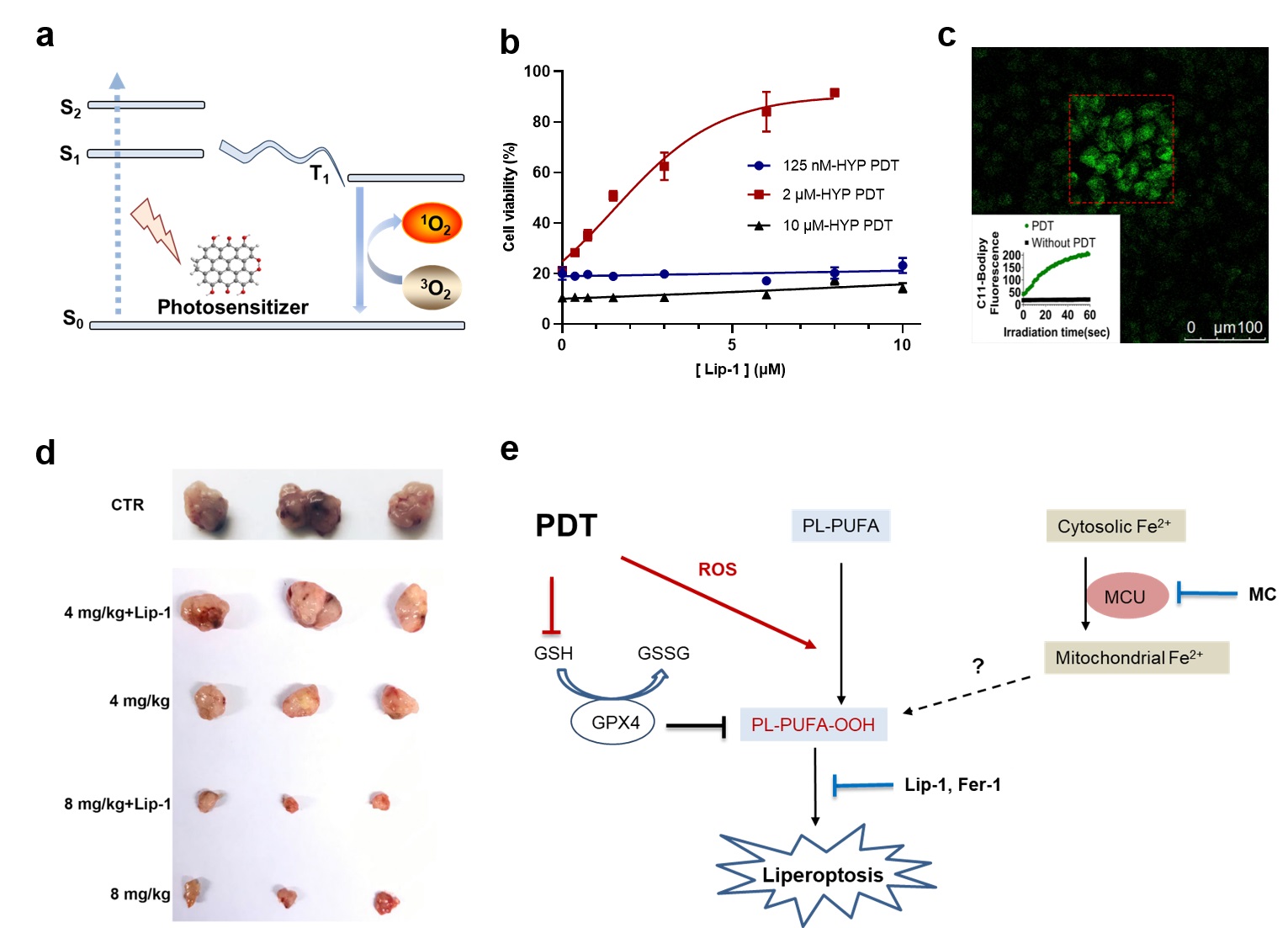
该研究发现光动力疗法(PDT)在特定的条件下,能在肿瘤细胞中直接引发非酶促的脂质过氧化,且该过程不依赖于经典铁死亡通路中关键的与脂质代谢相关的ALOXs和ACSL4酶。这种非酶促的脂质过氧化诱发肿瘤细胞发生了一种与经典铁死亡形态相似,但是在铁代谢上存在显著差异的死亡通路。该死亡通路可以被脂质过氧化的还原剂(Lip-1,Fer-1)有效地阻断,但是铁络合剂(DFO)却没有阻断效果。基于此与铁死亡不同的特征,该团队将这种特殊的细胞死亡通路命名为“Liperoptosis”,以突出脂质过氧化本身在细胞死亡中的决定性作用。进一步的研究表明,PDT在对经典铁死亡不敏感的肿瘤细胞中(比如MCF-7)能同样诱导脂质过氧化和Liperoptosis。此外,使用临床批准的光敏剂 Verteporfin,PDT抑制裸小鼠移植瘤生长的主要作用机制也是诱导细胞发生脂质过氧化和Liperoptosis。该研究为理解光动力疗法的免疫激活机制提供了一个新的角度。
北京大学药学院博士生水素芳是该论文的第一作者,刘国全研究员是论文的通讯作者,德国慕尼黑赫姆霍兹研究中心的Marcus Conrad教授是论文的共同作者。该研究得到了国家自然科学基金委的支持。

水素芳博士
原文链接:https://doi.org/10.1016/j.redox.2021.102056
【通讯作者简介】

刘国全,北京大学药学院研究员、博士生导师、天然药物及仿生药物国家重点实验室PI。长期致力于氧化应激在药理、病理中的作用机制研究,以及基于自由基的磁共振检测与新技术开发。以第一作者或通讯作者在Nat Chem、JACS、Free Radic Biol Med、Redox Biology 等国际学术期刊发表多篇学术论文。目前担任北京市波谱学会副理事长。

