张宏权团队发现致死性肠梗阻发生的新机制

慢性肠梗阻(CIPO)和巨膀胱微结肠肠道蠕动迟缓综合征(MMIHS)均为平滑肌运动障碍性疾病。1/3的先天性CIPO是平滑肌异常所导致,MMIHS也以功能性肠阻塞为主要特征的平滑肌功能紊乱。然而,对其发生的机理仍不完全了解。
近日,我室张宏权教授团队在生物医学1区杂志《Theranostics》上发表论文,报道了整合素相互作用蛋白Kindlin-2对于维持平滑肌的正常结构和功能至关重要。Kindlin-2在平滑肌组织中特异性缺失能够下调平滑肌肌丝组分蛋白Myh11, α-SMA, and CNN以及钙通道蛋白S100A14 和STIM1,同时诱导平滑肌细胞的凋亡。成年平滑肌Kindlin-2缺失小鼠可作为一种有效的假性肠梗阻动物模型,可用于肠梗阻发病机制、药物治疗和预后判断的研究。
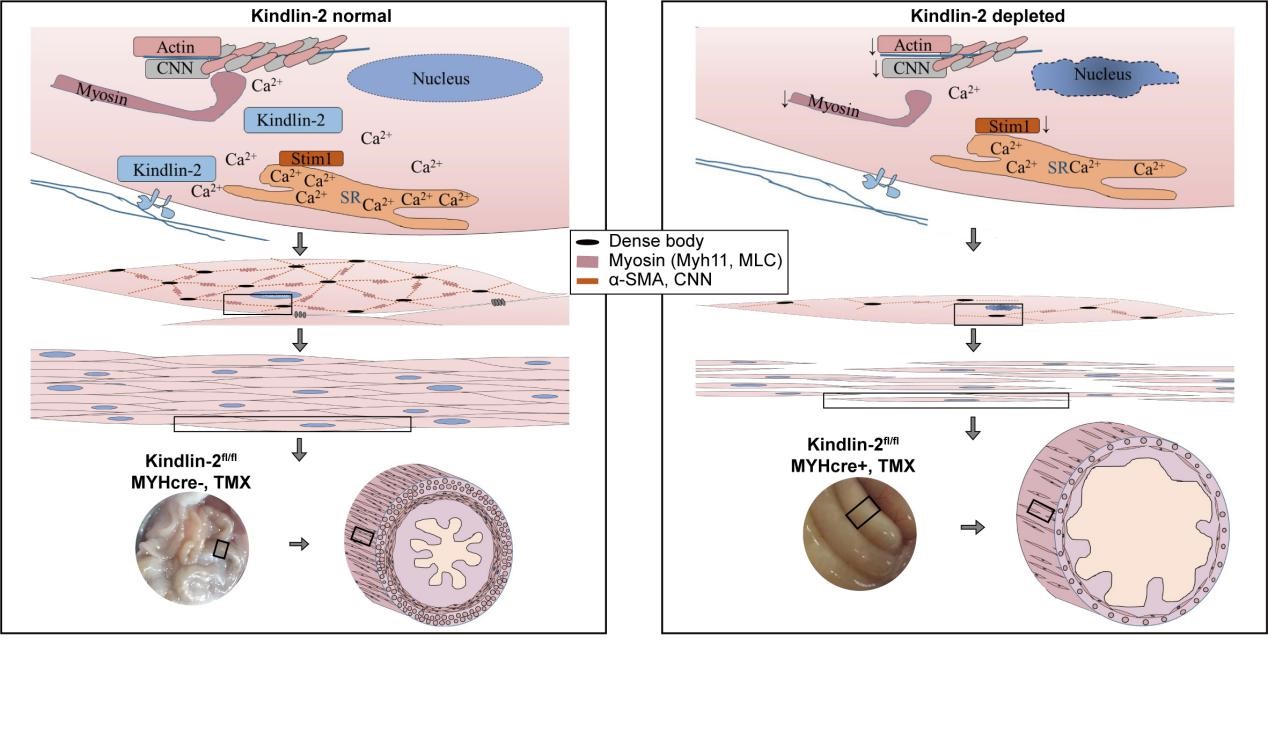
该研究利用基因敲除技术建立了两种Kindlin-2在平滑肌中特异性缺失的小鼠模型:胚胎期缺失Kindlin-2的cKO小鼠和成年后通过他莫昔芬诱导基因敲除的iKO小鼠。研究人员发现,在胚胎平滑肌中Kindlin-2的编码基因fermt2的缺失导致细胞凋亡,下调血管平滑肌细胞(SMC) 中的关键分子,损害平滑肌的发育,最终导致胚胎在E14.5时死亡。在功能上,他莫昔芬诱导的成年平滑肌Kindlin-2特异性敲除小鼠表现为血压下降、肠蠕动不足,并且小鼠最终死于肠梗阻。在结构上,Kindlin-2缺失也会导致平滑肌的骨架蛋白Myh11、α-SMA、CNN表达下调,肌丝截短,肌原纤维被破坏,以及小鼠体内平滑肌的收缩能力受损。在机制上,Kindlin-2的缺失通过下调钙结合蛋白S100A14和STIM1的表达,减少了原代血管平滑肌细胞(PVSMC) 内Ca2+的内流。该研究采用Kindlin-2基因缺失制备了CIPO和MMIHS的动物模型,揭示了肠梗阻中平滑肌运动障碍的新机制,对于药物治疗和预后判断有潜在的应用价值。
博士研究生和晓堃为本文的第一作者,导师张宏权教授和副导师战军副教授为共同通讯作者。该研究得到基础医学院孔炜教授、周菁研究员和付毅副教授及美国耶鲁大学医学院Wei Li教授的合作帮助。这项研究得到国家自然科学基金重点和面上项目、科技部重大基础研究项目、北京市自然科学基金重点项目及北京大学重点基础研究专项的支持。
链接:https://www.thno.org/v10p6182.htm
(基础医学院)

