席建忠课题组在人鼠肝癌致病异同机理方面取得研究进展
2016年3月18日,席建忠课题组在国际著名期刊Nature Communications上发表了题为“Differential TGFβ Pathway Targeting by miR-122 in Humans and Mice affects Liver Cancer Metastasis” 的论文。
该工作首次报道了一种全新的miRNA作用靶位点的“非典型、信号通路保守”进化模式:在脊椎动物中,保守的miRNA对重要的信号通路的作用是一致的,但作用的靶点在不同物种中有差异。进一步利用高通量实验方法证实这种“miRNA——靶基因”进化模式在自然界是普遍存在的。论文还揭示了肝脏特有的miRNA-122分子在人鼠中分别调控TGFβ信号通路中的不同靶基因,这是导致人、鼠肝癌发病不同后果的主要原因。
原发性肝癌是全球五大常见癌症之一,是癌症死亡的第二大原因。miRNA-122是肝脏特异表达的内源小RNA分子,在维持正常肝脏的生理功能、调节胆固醇的合成等方面具有重要作用,同时与人肝癌转移和生存期降低有密切的相关性。席建忠课题组深入分析前人研究结果时,发现miRNA-122表达量降低的小鼠没有发展成肝癌,甚至miRNA-122完全失活的小鼠也很少能发生肝癌的转移。这些结果与人类的临床结果存在着明显的矛盾。
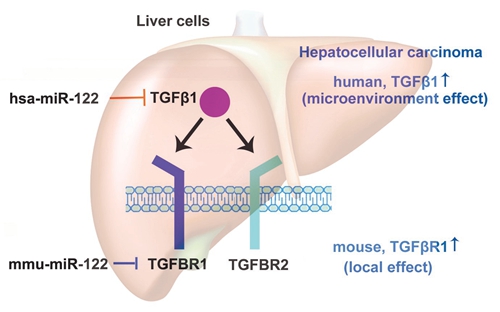
miRNA-122在人鼠肝脏中的调控作用
人们普遍认为miRNA的调控位点在生物进化过程中具有保守性,特别是像TGFβ1、TGFβR1等这些重要基因,它们的蛋白序列在脊椎动物中几乎完全一致。经过研究,席建忠课题组发现并证实:1、在人类肝细胞中,miRNA-122直接作用于TGFβ1基因,从而控制后者的表达量,而在小鼠肝细胞中,miRNA-122却直接调控TGFβ1的受体基因(TGFβR1)的表达量;2、这种调控方式进化上存在一定的规律,即,在灵长类动物中,miRNA-122作用于TGFβ1基因,在猪、小鼠、大鼠等其它物种中,则作用于TGFβR1基因;3、在正常肝脏细胞中,无论miRNA-122抑制TGFβ1还是TGFβR1,对TGFβ1信号通路的下游作用是一致的,但是当肝脏失去正常功能,miRNA-122 表达量下调,人和灵长类动物的肝脏中TGFβ1表达量会上升,而小鼠等动物肝脏中上升的是TGFβR1的表达量,二者对肝癌微环境有明显的不同作用,导致肝肿瘤恶性程度有很大差异。
这一发现为在人类和小鼠中观察到不同的肝癌病理表现提供了一个合理的解释。更重要的是,美国加州一家生物公司(Santaris Pharma)正在开展一项临床2期试验,试图通过沉默miRNA-122来抑制丙肝病毒。席建忠课题组的这项工作表明,降低miRNA-122将导致TGFβ1上升,有可能会产生一系列不良后果。此外,先前大量的研究已经表明,TGFβ1表达量还与免疫反应、代谢综合征、肝脏疾病、心脏病等生理病理过程存在密切关系。因此,这项工作也为深入研究肝脏疾病与心血管等疾病的相关性,特别是为这些疾病的治疗提供了全新的思路。
利用自主开发的自组装芯片技术(Nature Communications 2011 & Nature Cell Biology 2012),席建忠课题组还对人和小鼠中序列保守的260余条miRNA基因进行了大规模靶位点筛选,在HGF/HGFR、FGF/FGFR、TGFβ1/TGFβ1R等多个信号通路的重要基因中,同样发现大量 “种属依赖”的miRNA靶点“配体-受体互换模式”。课题组还发现miRNA调控的靶基因在不同物种中有较大的差异,暗示着基于传统小鼠等动物模型获得的miRNA功能并不一定能真实反映人类miRNA调控功能的情况。
这些成果使人们进一步认识了miRNA调控基因表达过程的复杂性和重要性,对重新审视了miRNA在发育、肿瘤等过程中的生理、病理作用,具有重要的学术意义。
该工作的第一作者是尹申意,是我室招聘的首批年薪博士后之一。范宇、张函槊、赵志华等学生为工作的顺利完成作出了重要贡献。通讯作者为席建忠教授。北京大学生命科学学院陆剑研究员、军事医学科学院生物工程研究所杨晓研究员等参与了研究。此外,该项工作得到了生物膜及膜生物工程国家重点实验室及国家自然科学基金委员会、科技部等的资助。
重点室办公室 供稿

